
Radiactividad II: Fuentes de Radiación y Efectos Biológicos
La semana pasada escribí una pequeña introducción sobre el tema de la radiactividad y os prometí una segunda parte, pues bien aquí la tenéis. Dicho sea de paso estoy planteándome escribir algún artículo más sobre este tema, ya que creo que...

Radiactividad I: Introducción Histórica y Conceptos Básicos
Hace unas semanas a raíz de la crisis de Fukushima estuve conversando con el técnico ambiental, a través del blog de la asociación, sobre el tema de la radiactividad; el caso es que a causa de esas conversaciones me entraron ganas de escribir un pequeño artículo sobre este tema y así lo he hecho. Como finalmente me ha quedado un poco extenso he decidido dividirlo en dos partes, una primera con una breve introducción histórica acompañada de algunos conceptos que he creído interesantes; y una segunda parte que trata sobre fuentes de radiactividad y efectos biológicos.
Una vez dicho esto os dejo con la primera parte, espero que os entretengáis leyéndolo tanto como yo me he entretenido escribiéndolo.
Introducción Histórica: Radiaciones Ionizantes y Modelo Atómico
En 1895, el físico Wihelm Roëntgen, cuando Estaba estudiando las características de la luz que salía de los tubos de rayos catódicos, descubrió el primer tipo de radiación artificial que ha utilizado el ser humano: los rayos X. Estos son una radiación electromagnética llamados así por su extraña naturaleza, ya que podían atravesar los materiales sin dañarlos.
 |
| Mano de la Sra, Röentgen |
El primero en clasificar los rayos emitidos por los núcleos radiactivos fue Ernest Rutherford, quién los denominó rayos alfa (α), beta (β) y gamma (ɣ). En 1902 Rutherford y Frederick Soddy descubrieron que cada emisión radiactiva altera al elemento que lo emite convirtiéndolo en otro diferente del sistema periódico, fenómeno al que denominaron transmutación.
En 1904 el físico inglés Joseph John Thomson propuso el primer modelo atómico, este consistía en una esfera de materia de carga positiva, en cuyo interior estaban incrustados unos gránulos de carga negativa, los electrones. Este modelo fue aceptado hasta que fue contradicho de forma empírica por los experimentos realizados por Rutherford en 1909; Rutherford bombardeó finas láminas metálicas con las llamadas partículas α. En estos experimentos se obtenía que algunas de estas partículas eran dispersadas, debido a la interacción de Coulomb, tal y como predecía el modelo de Thomson, pero un cierto número de ellas era desviado significativamente, a veces bajo ángulos de difusión mayores de 90 grados. Tales desviaciones no podrían ocurrir si el modelo de Thomson fuese correcto.
 |
| Modelo Atómico de Rutherford |
 |
| Modelo Atómico de Thompson |
Las conclusiones de Rutherford pusieron de manifiesto que el átomo estaba en gran parte hueco y que la carga positiva ocupaba un espacio reducido y constituía gran parte de la masa. De esta forma en 1911 Rutherford propuso un nuevo modelo atómico, el cuál consistía en un núcleo situado en la parte central cargado positivamente, y los electrones, con carga negativa, girando a su alrededor y manteniendo una gran distancia respecto al núcleo en relación al tamaño de este.
Aunque este modelo seguía presentando un problema, una partícula cargada eléctricamente en movimiento iría perdiendo energía, de forma que los electrones irían moviéndose cada vez más cerca del núcleo y acabarían precipitándose sobre este.
En 1913 el físico danés Niels Bohr dilucidó la solución a este problema con sus postulados dando lugar a un nuevo modelo atómico, en el cuál los electrones se movían a través órbitas estacionarias con valores definidos y cuantizados del momento angular, que eran múltiplos de la constante de Planck.
Esta teoría fue mejorada en 1916 por Arnold Sommerfeld quién consideró que las órbitas podían ser elípticas en planos bien definidos.
Aunque Rutherford y otros investigadores habían propuesto que debería existir otro tipo de partícula subatómica en el núcleo, ya que la masa de los átomos era mucho mayor de lo que se esperaba debido a su número de protones. Fue el físico inglés James Chadwick quién, en 1932, probó la existencia del neutrón con sus experiencias radiactivas. Esta partícula no tiene carga eléctrica y su masa es muy similar a la del protón.
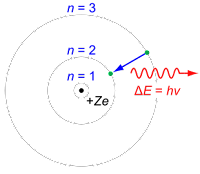 |
| Modelo Atómico de Bohr |
Algunos Conceptos Básicos
Como se ha explicado anteriormente el átomo está formado por un núcleo cargado positivamente. este está compuesto por dos tipos de partículas los protones, con carga positiva, y los neutrones, sin caga eléctrica. Estas partículas se denominan conjuntamente como nucleones.
El número de protones caracteriza al núcleo y este viene definido por el llamado número atómico (Z), este número determina las propiedades características de un átomo y además coincide con el número de electrones. El número másico (A) indica el número de nucleones, es decir es igual al número de protones más el número de neutrones (A=Z+N).
Un nucleido o núclido es cada una de las posibles agrupaciones de nucleones. Los nucleidos que tienen el mismo número másico se denominan isóbaros, si tienen el mismo número de neutrones se denominan isótonos. Todos los nucleidos caracterizados por el mismo número atómico pero diferente número de neutrones se denominan isótopos, los cuales tienen propiedades químicas idénticas pero comportamiento nuclear diferente. También existen otro tipo de nucleidos llamados isómeros que aunque tienen el mismo número de protones y de neutrones, sus propiedades varían debido a una diferente posición de los nucleones.
Para un determinado número atómico existe cierto límite tanto inferior como superior respecto al número de neutrones, en el que forman isótopos estables. Los nucleídos que estén fuera de esta banda de estabilidad tenderán a sufrir transformaciones nucleares que aumentarán la estabilidad del conjunto, este fenómeno es observable a través de la emisión de partículas y radiaciones, se conoce como radiactividad, y se denominan radionucleidos o radioisótopos a los nucleidos inestables o radiactivos.
Tipos de radiación ionizante
Partículas α: Emisión constituida por partículas cargadas positivamente denominadas partículas α. Experimentalmente se ha demostrado que estas partículas son átomos de helio doblemente ionizados. Estas partículas tienen una energía inicial muy alta pero la pierden rápidamente porque la invierten en ionizar el medio. Por eso solo penetran unos centímetros en el aire y del orden de 1mm en materiales más densos. Al ceder mucha energía en su recorrido pueden causar graves daños biológicos
Partículas β: Una partícula beta es un electrón(partículas β-) o positrón (partículas β+) muy energético. (El positrón es la antipartícula del electrón. Tiene la mayoría de las demás propiedades del electrón, excepto su carga, que es de igual magnitud, pero de signo positivo). Tienen mayor capacidad de penetración que las partículas alfa pero los daños son inferiores a los de estas, aunque apreciables.
Rayos ɣ: Es una radiación electromagnética emitida por un núcleo cuando experimenta una transición de un estado energético más alto a otro estado energético más bajo. El número de protones y neutrones del núcleo no varía en estas transiciones. ceden muy poca energía en su recorrido y tienen una capacidad de penetración grande. Dañan las células que se encuentran en su camino.
 |
| A pesar de lo que dice Marvel, los rayos gamma no crean superhéroes ;) |
Rayos X: Son una radiación electromagnética y, en ese sentido, son idénticos a los rayos gamma. La distinción entre ambos se halla en su origen. Mientras que los rayos gamma se originan en el núcleo atómico, los rayos X resultan de interacciones entre electrones. Al igual que los rayos gamma ceden muy poca energía en su recorrido y tienen una capacidad de penetración grande aunque algo menor que la de estos. Dañan las células que se encuentran en su camino.
Neutrones: Generalmente, los neutrones no son emitidos como resultado directo de la desintegración radiactiva natural, sino que se producen durante reacciones nucleares. Los reactores nucleares son los que generan neutrones con mayor abundancia, pero los aceleradores de partículas y las fuentes especiales de neutrones, denominadas fuentes (α, n), también pueden producir neutrones. Tienen una elevada capacidad de penetración y sus efectos biológicos son grandes ya que ceden mucha energía en su recorrido.
 |
| Comparación de la capacidad de penetración |
Imágenes destacadas procedentes de Wikipedia Commons (Mano de la Sra, Röentgen, Modelo Atómico de Thompson, Modelo Atómico de Rutherford, Modelo Atómico de Bohr, Comparación de la capacidad de penetración) y Tim Norris

Radiactividad I: Introducción Histórica y Conceptos Básicos
Hace unas semanas a raíz de la crisis de Fukushima estuve conversando con el técnico ambiental, a través del blog de la asociación, sobre el tema de la radiactividad; el caso es que a causa de esas conversaciones me entraron ganas de escribir un p...

ATC Villar de Cañas y el refranero castellano
Oh energía nuclear¡¡¡ siempre en boca de todos¡¡¡ alimentando tertulias, planteando eternamente conflictos y disputas, con tus defensores a ultranza, con tus detractores sin concesiones….. Pero las cosas no son ni blancas ni negras, pienso que son grises y en mi humilde opinión con respecto a este tema pienso que la energía nuclear a dado […]

El fin de Garoña
La energía nuclear en España Parte de la energía eléctrica que consumimos en España procede de los reactores nucleares que existen, sobre todo, en el norte del país. Hoy en día se mantienen en marcha siete, ubicados en cinco centrales: Almaraz I y II, Ascó ...

¿Adiós Garoña?
Dice la prensa que hoy desconectan Garoña, adelantando su cierre. La central nuclear más antigua de España parece caer víctima de la reforma energética. Y digo parece porque no está claro que el anuncio sea definitivo: estamos ante un nuevo pulso, esta vez eléctricas – gobierno. En este nuevo capítulo … Continue reading →
